在方才竣事的由国际肺癌研究协会(IASLC)举行的世界肺癌年夜会(WCLC)上,第一三共携其领先DXd抗体偶联药物(ADC)产物组合表态新加坡。本文特梳理出色研究内容,带读者直击WCLC出色现场。
2期临床研究HERTHENA-Lung01 成果显示,Patritumab Deruxtecan在EGFR突变的转移性非小细胞肺癌患者中显示出具有临床意义的持久疗效
Patritumab deruxtecan是一款采取第一三共独有的DXd ADC手艺设计的潜伏首个靶向HER3的抗体偶联药物(ADC)。
经盲法自力中间(BICR)评估,在225例EGFR突变的NSCLC患者中,patritumab deruxtecan(5.6 mg/kg)组患者确认的客不雅减缓率(ORR)为29.8%(95% CI:23.9~36.2)。此中1例完全减缓(CR),66例部门减缓(PR),99例疾病不变。中位减缓延续时候(DOR)为6.4个月(95% CI:4.9~7.8),疾病节制率(DCR)为73.8%(95% CI:67.5~79.4)。截止至2023年05月18日数据截至日期,中位无进展保存期(PFS)为5.5个月(95% CI:5.1~5.9个月),中位总保存期为11.9个月(95% CI:11.2~13.1个月)。
各亚组的疗效成果一致,此中包罗209名患者地点的既往接管过三代EGFR TKI和含铂化疗医治亚组。Patritumab deruxtecan 针对分歧的EGFR TKI耐药机制和分歧的肿瘤HER3膜表达程度患者,均不雅察到抗肿瘤活性。
按照中枢神经系统(CNS)BICR评估显示,在30例基线有脑转移且既往未接管过放疗的患者亚组中不雅察到的颅内ORR为33.3%(95% CI:17.3~52.8%)。在这些患者中,有9例患者到达颅内完全减缓,1例到达颅内部门减缓,13例疾病不变。不雅察到的CNS DOR为8.4个月(95% CI:5.8~9.2)。
截至2022年11月21日数据截止时,HERTHENA-Lung01临床研究中不雅察到patritumab deruxtecan的平安性特点与先前的临床实验一致。医治中呈现的不良事务(TEAE)致使终止医治的比例较低(7.1%)。64.9%的患者呈现了3级或3级以上的TEAE。最多见的(>5%)3级或3级以上TEAE包罗血小板削减(21%)、中性粒细胞削减(19%)、贫血(14%)、白细胞削减(10%)、疲惫(6%)、低钾血症(5%)、乏力(5%)。经自力裁定委员会肯定,12例患者(5.3%)呈现确认的医治相干间质性肺疾病(ILD)。年夜大都ILD事务级别较低,此中1例为1级事务,8例为2级事务。不雅察到两例3级事务和1例5级事务。
经盲法自力中间(BICR)评估,在HERTHENA-Lung01临床研究中,51%的患者(n=115)有中枢神经系统转移病史,此中32%患者(n=72)基线时有脑转移,33%患者(n=75)基线时有肝转移。63% (n=142)和36% (n=82)的患者别离在基线时检测到EGFR外显子19缺掉或外显子21 L858R突变,此中一例患者二者都有。
在局部晚期/转移性疾病阶段,患者既往接管过的全身医治线数中位值为3(规模为1~11),包罗含铂化疗(100%)、三代EFGR TKI(93%)和免疫疗法(40%)。截至至2023年5月18日数据截止日期,中位延续时候为18.9个月(14.9~27.5),13例患者仍在接管patritumab deruxtecan医治。
HERTHENA-Lung01数据成果总结
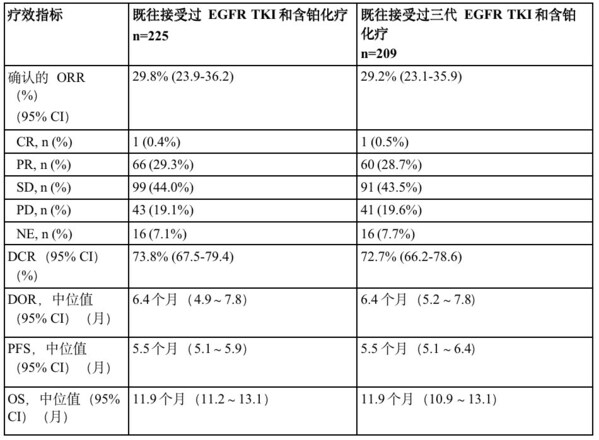
CR,完全减缓;DCR,疾病节制率;DOR,减缓延续时候;NA,无;NE,不成评估;ORR,客不雅减缓率;OS,总保存期;PR,部门减缓;PFS,无进展保存期;PD,疾病进展;SD,疾病不变。
II期临床研究DESTINY-Lung02最新数据证实,优赫得®医治既往经治HER2突变转移性非小细胞肺癌的患者取得了持久的肿瘤减缓
优赫得®是一款采取独有手艺设计的HER2靶向抗体偶联药物(ADC),由第一三共和阿斯利康配合开辟和贸易化。
经盲法自力中间审查(BICR)评估成果显示,5.4 mg/kg医治组和6.4 mg/kg医治组简直认客不雅减缓率(ORR)别离为49.0%(95%置信区间[CI]:39.0~59.1)和56.0%(95% CI:41.3~70.0)。5.4 mg/kg医治组中不雅察到1例(1.0%)完全减缓(CR)和49例(48.0%)部门减缓(PR),6.4 mg/kg医治组中不雅察到2例(4.0%)全数减缓和26例患者(52.0%)部门减缓。5.4 mg/kg剂量组疾病节制率(DCR)达93.1% (86.4 ~ 97.2),6.4 mg/kg剂量组为92.0%(80.8 ~ 97.8)。5.4 mg/kg医治组的中位减缓延续时候(DoR)为16.8个月(95% CI:6.4~不成估量[NE]),6.4 mg/kg医治组未到达中位减缓延续时候(95% CI:8.3~NE)。
按照BICR评估,5.4 mg/kg组的中位PFS为9.9个月(95% CI:7.4~NE),6.4 mg/kg组为15.4个月(95% CI:8.3~NE)。5.4 mg/kg组的中位OS为19.5个月(95% CI:13.6~NE),6.4 mg/kg医治组为未到达(95% CI:12.1~NE)。截止日期至2022年12月23日的数据,5.4 mg/kg医治组(n=102)的中位随访时候为11.5个月,6.4 mg/kg医治组(n=50)的中位随访时候为11.8个月。
在DESTINY-Lung02中,优赫得®5.4 mg/kg医治组的患者平安性特点更佳,两种剂量均未发现新的平安旌旗灯号。与5.4 mg/kg组比拟,优赫得®6.4 mg/kg组的3级医治中不良事务(TEAE)产生率更高。在优赫得®5.4 mg/kg组或6.4 mg/kg组医治的所有患者中,别离有38.6%和58.0%患者呈现了3级或3级以上的医治相干TEAE。最多见的3级或3级以上医治相干TEAE为中性粒细胞削减症(18.8% [5.4 mg/kg];36.0% [6.4 mg/kg])和贫血(10.9% [5.4 mg/kg];16.0% [6.4 mg/kg])。经自力裁定委员会肯定,共陈述了27例与医治相干的间质性肺疾病(ILD)或非传染性肺炎病例(5.4 mg/kg医治组产生率为12.9%;6.4 mg/kg医治组产生率为28.0%)。在5.4mg/kg医治组年夜大都事务级别较低(1级或2级事务为,10.9%,此中4例1级事务和7例2级事务),陈述了1例3级事务、0例4级事务和1例5级事务。在6.4mg/kg医治组中年夜大都事务级别较低(1级或2级事务为26%,此中4例1级事务9例2级事务),陈述了0例3级事务、0例4级事务和1例5级事务。
DESTINY-Lung02首要阐发成果
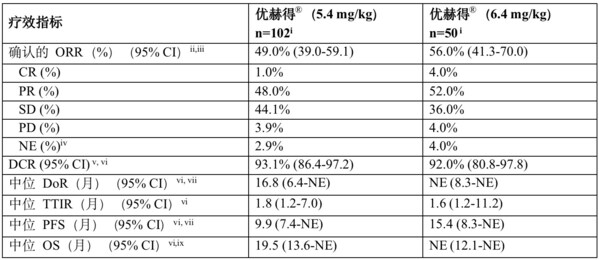
CI,置信区间;CR,完全减缓;DCR,疾病节制率;DoR,减缓延续时候;NE,不成估量;ORR,客不雅减缓率;OS,总保存期;PD,疾病进展;PFS,无进展保存期;PR,部门减缓;SD,疾病不变;TTIR,至初次减缓时候
i. 数据截至日期: As of December 23, 2022
ii. 按照RECIST v1.1经由过程BICR评估确认的CR或PR的患者比例
iii. 客不雅减缓率= 完全减缓+部门减缓
iv. 5.4 mg/kg组三例患者为NE(一例患者因新冠肺炎(COVID)疫情而从未接管医治;两例患者在初次肿瘤评估前终止医治);6.4 mg/kg组一例患者为NE(在初次肿瘤评估前因不良事务而终止医治)。
v. 疾病节制率=完全减缓+部门减缓+疾病不变
vi. BICR评估
vii. 在5.4 mg/kg组和6.4 mg/kg组中,别离有60.0%和75.0%的患者被审查。
viii. 在5.4 mg/kg组和6.4 mg/kg组中,别离有56.9%和60.0%的患者被审查。
ix. 在5.4 mg/kg组和6.4 mg/kg组中,别离有63.7%和72.0%的患者被审查。
1b期临床研究TROPION-Lung04最新数据显示,datopotamab deruxtecan结合度伐利尤单抗用在一线医治晚期肺癌患者具有杰出的临床疗效
Dato-DXd是一款由第一三共和阿斯利康配合开辟,采取独有DXd-ADC手艺设计的开云体育appTROP2靶向抗体偶联药物(ADC)。
在既往未接管过医治的患者中, Dato-DXd结合度伐利尤单抗(n=14)的客不雅减缓率(ORR)为50.0%(95%置信区间[CI]:23.0-77.0,包罗7例部门减缓(PR)),疾病节制率(DCR)为92.9%(95%置信区间[CI]:66.1-99.8)。接管Dato-DXd结合度伐利尤单抗和卡铂(n=13)医治的患者中表示出更高的减缓率,ORR为76.9%(95% CI:46.2-95.0,包罗10例PR),DCR为92.3%(95% CI:64.0-99.8)。不管PD-L1表达程度,均不雅察到减缓。
在既往接管过医治和未接管过医治的患者中,Dato-DXd结合度伐利尤单抗±卡铂的平安性特点与其他临床研究和每种药物的已知平安性特点连结一致。在接管双联和三联医治的患者中,3级或3级以上医治中产生的不良事务(TEAE)产生率别离有42.1%和71.4%。接管三联医治的患者中,最多见的3级或3级以上TEAE(产生率>15%)为贫血(36%)和血小板削减症(21%)。接管双联医治排队中,未发现产生率≥15%的3级或3级以上TEAE。各医治队列间,自力委员会将4例间质性肺疾病(ILD)或非传染性肺炎事务鉴定为药品相干事务,包罗1例1级事务、2例2级事务和1例4级事务。未不雅察到5级ILD事务。
在双联队列中,73.7%(n=14/19)的患者既往未接管过医治。三联队列中,92.9%(n=13/14)的患者既往未接管过医治。在双联和三联队列中,按PD-L1表达程度将患者分为PD-L1表达Ifinatamab Deruxtecan在晚期小细胞肺癌患者的初期临床研究中表示出持久疗效
Ifinatamab deruxtecan是一种采取第一三共独有的DXd ADC手艺设计的潜伏first-in-class靶向B72023-H3抗体偶联药物(ADC)。
小细胞肺癌(SCLC)约占所有肺癌的15%。年夜约65%的SCLC肿瘤中B7-H3呈高表达,这与疾病进展和较低的保存率相干。在这项1/2期临床研究剂量递增部门,在接管ifinatamab deruxtecan(6.4~16.0 mg/kg)医治的21例晚期SCLC患者中,确认的客不雅减缓率(ORR)为52.4%(95% CI:29.8~74.3)。不雅察到1例患者到达完全减缓(CR)和10例患者到达部门减缓(PR)。不雅察到的中位减缓延续时候(DOR)为5.9个月(95% CI:2.8-7.5)。截至2023年01月31日数据截止日期,中位无进展保存期(PFS)为5.6个月(95% CI:3.9~8.1),中位总保存期(OS)为12.2个月(95% CI:6.4~NA)。
在分歧的B7-H3卵白表达程度患者中不雅察到接管ifinatamab deruxtecan医治致使的肿瘤缩小,未不雅察光临床有用性参数与B7-H3卵白表达之间存在较着的相干性趋向。
Ifinatamab deruxtecan在SCLC患者中的平安性特点与既往该1/2期临床研究的整体人群的陈述成果一致。3级或3级以上医治中呈现的不良事务(TEAE)产生率为36.4%。患者产生的最多见(>20%)TEAE为恶心(59.1%)、疲惫(50.0%)、贫血(27.3%)、吐逆(27.3%)和食欲降落(22.7%)。经自力裁定委员会肯定,不雅察到1例与医治相干的间质性肺疾病(ILD)-/非传染性肺炎的2级事务。有1例5级COVID-19肺炎事务,被肯定为与医治无关。
在SCLC患者亚组中,2例患者(9.1%)在基线时存在脑转移。局部晚期或转移性患者既往接管过量线医治,既往全身医治线数中位值为2(规模:1~7),包罗含铂化疗(100%)、免疫医治(81.8%)、紫杉烷化疗(22.7%)和伊立替康或拓扑替康化疗(22.7%)。中位随访时候为11.7个月(95% CI:4.63~12.88),2例患者仍在接管ifinatamab deruxtecan医治。
1/2期研究SCLC亚组阐发总结
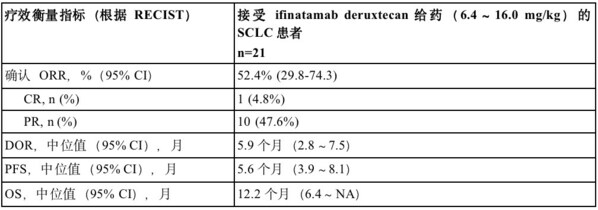
CR=完全减缓;DOR=减缓延续时候;NA=不合用;ORR=客不雅减缓率;OS=总保存期;PR=部门减缓;PFS=无进展保存期;RECIST=实体瘤疗效评价尺度;SCLC=小细胞肺癌。
关在第一三共和阿斯利康的合作
第一三共与阿斯利康别离在2019年3月和2020年7月告竣全球合作,配合开辟并贸易化优赫得®和datopotamab deruxtecan(Dato-DXd),在日本市场第一三共具有各款ADC产物的独家权益。第一三共负责优赫得®和datopotamab deruxtecan的出产和供给。
关在第一三共DXd ADC产物组合
第一三共DXd ADC产物组合今朝首要有六款处在临床开辟阶段的ADC药物,涵盖多种癌症类型。优赫得®(HER2靶向ADC)和datopotamab deruxtecan(Dato-DXd,TROP2靶向ADC)今朝正由第一三共与阿斯利康配合开辟并在全球规模内贸易化。别的四款第一三共DXd ADC包罗patritumab deruxtecan(HER3-DXd,HER3靶向ADC)、ifinatamab deruxtecan(I-DXd;DS-7300,B7-H3靶向ADC)和raludotatug deruxtecan(R-DXd;DS-6000,CDH6靶向ADC)和DS-3939(TA-MUC1靶向ADC)。
每款ADC均采取第一三共独有的DXd ADC手艺设计,用在靶向表达特定细胞概况抗原的癌细胞,并将细胞毒性有用载荷递送至癌细胞内部。
Datopotamab deruxtecan、ifinatamab deruxtecan、patritumab deruxtecan、raludotatug deruxtecan和 DS-3939均为在研药物,还没有在任何国度/地域获批用在任何顺应症。还没有完全肯定平安性和疗效。
关在第一三共
第一三共是一家为社会可延续成长做进献的立异型全球医疗保健公司,致力在发现、开辟和供给新的尺度疗法,以提高世界各地患者的糊口质量。第一三共专注制药行业120余年,凭仗其世界一流的科学和手艺,为癌症、血汗管疾病和其他医疗需求远未获得知足的疾病患者研发新的医治方式和立异药物。
欲领会更多信息,请拜候www.daiichisankyo.com.
声明:本文触及的实验用药品用法还没有在中国获批,第一三共不保举任何未被获批的药物利用
责任编纂:赵硕俗语说“男怕入错行,女怕嫁错郎”既然,已经经选择了老公,而且他是做轮胎的,那不管怎样都要走下去,但他
此刻整个轮胎行业都漫溢着不景气的征象,轮胎厂家、轮胎经销商或者者是轮胎店都感觉出路苍茫,尤为是方才已
事情压力很是年夜情况很是压制,员工瓜葛很是差都是由于事情的缘故原由,常常拿钢管打斗,差人常常开车进厂
曾经几什么时候,换轮胎都是主顾亲自登门,并扣问轮胎以及安装的具体环境。此刻天天热切的盼着主顾登门,自
3月13号上午8点多钟,在扬州运西西路戚桥村段,一辆直行轿车因为轮胎忽然爆胎掉控,将一行人撞倒就地身